Uporaba PCR testov za diagnozo COVID-19

Članek, ki si ga boste v nadaljevanju prebrali, in ga objavljamo z dovoljenjem avtorjev, je bil prvič objavljen v zborniku Koronska kriza. Avtorja članka sta dr. Igor Pušnik, profesor (Univerza v Ljubljani, Fakulteta za elektrotehniko, Laboratorij za metrologijo in kakovost) in dr. Jerneja Tomšič, raziskovalec (City of Hope National Medical Center, USA).
Povzetek
Članek opisuje problematiko uporabe testov za diagnozo COVID-19. Ker je test merilne narave, je predhodno pojasnjena problematika merjenj s stališča točnosti in sledljivosti, kar je tudi glavni namen vsakega merjenja. Opisan je tudi splošen princip, kako se določi prava oziroma referenčna vrednost merjene veličine.
Za test, ki se po celem svetu uporablja za diagnozo virusa, so uporabili PCR tehnologijo in pri tem vidimo vsaj dva problema:
- PCR pomnoži le nek delček genoma, ki naj bi bil specifičen za SARS-CoV-2, kar je zelo daleč od diagnoze bolezni,
- PCR sloni na tem, da sekvence, ki se uporabljajo v testu, resnično pripadajo genomu virusa SARS-CoV-2. V članku smo opisali metodo, po kateri so pridobili sekvenco genoma SARS-CoV-2.
Ta metoda pa je problematična, ker se sekvenca ni dobila iz očiščenega virusa temveč iz materiala, v katerem je veliko različnih RNK molekul (tudi iz človeških celic). Problem je tudi v tem, ker metoda sekvenciranja treh pacientov, ki je bila objavljena v NEJM, ni podrobno napisana. Kakor je biokemik in izumitelj Kary Mullis trdil zadnjih 20 in več let, tudi po našem mnenju PCR tehnologija ne bi smela biti uporabljena za diagnozo bolezni COVID-19.
1. Merjenje: točnost in sledljivost
1.1 Uvod
Ljudje neprestano merimo. Večino meritev, ki jih izvajamo, delamo celo nezavedno. Vsak dan se velikokrat sprašujemo in merimo celo brez merilnih naprav, na primer kakšno bo vreme, kako toplo bo, kako dolgo traja nek dogodek, kako daleč je nek objekt, kakšno maso ima nek predmet, kako hitro se gibljemo, koliko tekočine smo spili, hrane pojedli, itd. Večina teh meritev temelji na naših občutkih, zato so takšne meritve zelo subjektivne in močno odvisne tudi od naših izkušenj s tovrstnimi merjenji.
Nekatere od teh meritev, ki jih izvajamo subjektivno, pa morajo biti vseeno izjemno zanesljive. Če na primer prehitevamo vozilo na navadni, dvopasovni cesti, moramo zelo dobro oceniti razpoložljivo razdaljo za prehitevanje, našo hitrost, hitrost nasproti vozečega vozila in s tem potreben čas za varen manever prehitevanja. Če smo se ušteli pri katerikoli od ocen, ki so popolnoma subjektivne in praktično podzavestno določene, lahko zaidemo v resne težave in izpostavimo sebe ter druge celo smrtni nevarnosti.
1.2 Osnovni pojmi pri merjenjih
Da bi se izognili podobnim situacijam, se poskušamo v čim večji meri zanašati na objektivne meritve, ki jih praviloma izvajajo merilne naprave. Izmerjene vrednosti, ki jih izvedejo merilne naprave pa je treba seveda ustrezno obdelati in interpretirati, da si z njimi lahko pomagamo pri odločitvah o nadaljnjih ukrepih. Osnovni namen merjenja (measurement) je torej pridobitev merilnega rezultata (measurement result). Merjenje je postopek empiričnega in objektivnega prirejanja simbolov lastnostim nekega objekta ali dogodka realnega sveta na tak način in s takim namenom, da se le-tega opiše oziroma ovrednoti.
Preprosteje povedano z merjenjem poskušamo objektivno določiti pravo vrednost merjenca (measurand). Meritev se torej začne z ustrezno specifikacijo merjene veličine, izbiro ustrezne merilne metode in izvedbo merilnega postopka. Večina ljudi si predstavlja oziroma verjame, da so izmerjene vrednosti, ki jih prikažejo merilne naprave, točne, kar pomeni, da kažejo pravo vrednost (true value) merjene veličine (measured quantity). Le-ta bi bila določljiva z idealnim merjenjem, ki v osnovi ne obstaja. Zato v praksi govorimo o dogovorjeni pravi vrednosti (conventional true value), ki je vrednost, pripisana določeni količini in sprejeta, včasih po dogovoru, kot primerna za določen namen.
Točnost (accuracy) pomeni ujemanje izmerjenih vrednosti s (dogovorjeno) pravo vrednostjo merjene veličine, [1]. Tega pojma ne smemo enačiti ali zamenjati s pojmom natančnost (precision), ki pomeni zgolj dobro medsebojno ujemanje izmerjenih vrednosti oziroma dobro ponovljivost (repeatability). Pojma zelo nazorno prikažemo s slikami tarče, kjer imamo naslednje primere:

Točnosti ne moremo zagotoviti, v kolikor merilne naprave niso umerjene ali kalibrirane. Umerjanje ali kalibracija (calibration) je niz operacij za ugotavljanje povezave med vrednostmi, ki jih kaže merilni instrument ali merilni sistem, oziroma vrednostmi, ki jih predstavlja opredmetena mera ali referenčni material, in pripadajočimi vrednostmi, realiziranimi z etaloni, pod določenimi pogoji. Kalibracija je osnovni pogoj za zagotavljanje sledljivosti (traceability) meritev. Sledljivost je lastnost merilnega rezultata ali vrednosti etalona, ki omogoča navezavo na navedene reference, ponavadi nacionalne ali mednarodne etalone, skozi neprekinjeno verigo primerjav, ki imajo vse opredeljene negotovosti.
Kalibracija z drugimi besedami pomeni ugotavljanje točnosti, ki predstavlja ujemanje prikazane vrednosti merilnega instrumenta s pravo vrednostjo merjene veličine. Redke merilne naprave imajo možnost, da jih po ugotovljenem odstopanju od prave vrednosti lahko korigiramo in s tem nastavimo kazanje točne vrednosti. Četudi nam uspe določiti korekcijo merilne naprave ali merilnega sistema, ki jo potem v večini primerov upoštevamo “ročno”, v manj primerih pa lahko izvedemo nastavitev (adjustment) kazanja na točno vrednost, je vsaka meritev tudi v primerih, ko znamo določiti pravo vrednost, bolj ali manj negotova.
Merilna negotovost (measurement uncertainty) je parameter, ki opisuje raztros vrednosti, ki ga lahko upravičeno pripišemo izmerjeni vrednosti. Merilne negotovosti so lahko zelo različne [2], predvsem pa so sestavljene iz velikega števila prispevkov, ker nobena meritev v praksi ni izvedena v idealnih pogojih. Tipične vplivne veličine, ki so vzrok merilne negotovosti, so:
- nepopolna definicija merjene veličine
- stabilnost in homogenost merjenca (pomembnost pravilnega vzorčenja)
- postopek merjenja
- merilni instrument ali merilni sistem
- izvajalec meritev (sposobnost in usposobljenost)
- pogoji okolja (temperature, vlaga, zračni tlak, vibracije, prah, elektromagnetne motnje,…)
Meroslovci ali metrologi, ki se ukvarjamo z merjenji, imamo vedno isti cilj. Izvajati čim bolj točne, čim manj negotove in predvsem tudi čim bolj sledljive meritve. Slednje pomeni, da jih na osnovi dovolj podrobno zapisanih informacij o posamezni meritvi, lahko pod enakimi ali drugačnimi pogoji ponovi tudi nekdo drug. Na ta način se v praksi potrjujejo ali ovržejo rezultati meritev. Podrobno branje in razlaga o merjenjih ter merilni negotovosti je podano v mednarodnem dokumentu, ki ga je izdal Mednarodni urad za uteži in mere BIPM [3].
1.3 Določitev prave vrednosti merjene veličine
Nek laboratorij ima lahko poleg vrhunske opreme nadarjeno delovno silo, vendar tudi takrat ne morete biti popolnoma prepričani, da bodo sporočeni rezultati vedno točni in brez negotovosti. Z namenom potrjevanja usposobljenosti laboratorijskih zmogljivosti, se izvajajo preskusi usposobljenosti (proficiency testing), ki so tako pomemben element akreditacije preskusnih in kalibracijskih laboratorijev v skladu s standardom ISO/IEC 17025, [4], da ima celo lasten standard ISO/IEC 17043, [5]. Medicinski laboratoriji uporabljajo poseben standard ISO 15189 [6], ki je bil razvit na osnovi standarda ISO/IEC 17025 in podaja zahteve za kakovost in kompetence medicinskih laboratorijev.
Kemijske, biološke, in mikrobiološke meritve so specifične s stališča merjenja, kajti pri teh meritvah kot merjenec nastopajo t.i. vzorci, ki morajo biti reprezentativni. Reprezentativni vzorec je podskupina populacije, pri kateri na osnovi njenih značilnost lahko dovolj dobro sklepamo na značilnosti večje skupine oziroma celotne populacije. To še zdaleč ni enostavno, zato je vzorčenje postopek, ki mu je treba posvetiti posebno pozornost in temu so namenjeni številni zapisi, znanstvene razprave ter standardi ali njihovi sklopi [7, 8].
1.4 Medlaboratorijske primerjave (ILC-Interlaboratory comparisons)
Te primerjave so organizirane bodisi za preverjanje usposobljenosti laboratorijev, ali svojim strankam posredujejo točne rezultate preskušanja ali kalibracij, bodisi za ugotavljanje, ali določena analitska metoda deluje dobro in je primerna za predvidene namene. Samo tiste metode, ki izpolnjujejo stroge zahteve takšnih študij, so lahko predmet standardizacije s strani evropskih ali mednarodnih organov za standardizacijo (Evropski odbor za standardizacijo, CEN in Mednarodna organizacija za standardizacijo, ISO), [9]. Vsi akreditirani laboratoriji morajo sodelovati v medlaboratorijskih primerjavah, da ohranijo svojo tehnično usposobljenost in potrdijo sprejemljivost svojih rezultatov strankam.
Medlaboratorijske primerjave ponujajo odlično priložnost za potrjevanje laboratorijske učinkovitosti in merilnih procesov. Rezultati medlaboratorijskih primerjav v celoti odražajo kombinacijo sprejetih praks, kot so veljavnost sprejetih merilnih postopkov, delovanje sistema kakovosti, sledljivost delovnih etalonov in usposobljenost laboratorijskih delavcev. Na osnovi rezultatov se po potrebi lahko prilagodi oziroma izboljša merilne postopke ter po potrebi sprejme ustrezne korektivne ukrepe.
V splošnem pri izvedbi medlaboratorijske primerjave referenčni laboratorij izbere oziroma pripravi etalon ali material kot vzorec in določi njegovo referenčno vrednost, ki drugim sodelujočim laboratorijem ni znana. V takšnih primerih govorimo o uporabi referenčnih etalonov ali referenčnih materialov. Le-ti se razdelijo med sodelujoče laboratorije, ki izvedejo meritve in nato svoje neodvisno pridobljene vrednosti sporočijo referenčnemu laboratoriju, ki jih primerja z znano vrednostjo ter ugotovi razlike od znane vrednosti in oceni ustreznost sporočenih negotovosti.
To so primeri, ko je referenčni laboratorij na višjem hierarhičnem nivoju od sodelujočih laboratorijev in ima (naj)boljše merilne zmogljivosti. Vedno pa v verigi sledljivosti pridemo do vrha piramide, ko primerjava z etalonom ali referenčnim materialom višjega reda ni več mogoča. V takšnih primerih se za določitev referenčne vrednosti v medlaboratorijsko primerjavo izbere laboratorije z najboljšimi merilnimi zmogljivostmi.
Na najvišjem svetovnem nivoju v okviru Metrske konvencije [10], govorimo o t.i. ključnih primerjavah (key comparisons), katerih cilj je določitev referenčne vrednosti ključne primerjave (key comparison reference value). Metrska konvencija je mednarodna pogodba, ki je podlaga za mednarodni dogovor o merskih enotah mednarodnega sistema merskih enot SI. Poleg ustanovitve BIPM in določitve načina financiranja ter upravljanja dejavnosti BIPM je Metrska konvencija omogočila ustanovitev stalne organizacijske strukture vlad držav članic, da v vseh zadevah v zvezi z merskimi enotami delujejo soglasno. Konvencijo so v Parizu 20. maja 1875 podpisali predstavniki sedemnajstih držav, leta 1921 pa so jo nekoliko popravili, da bi razširili področje uporabe in odgovornosti BIPM.
Od 20. maja 2019 so vse enote SI opredeljene kot naravne konstante. S tem je iz uporabe izginil še zadnji artefakt v meroslovju, t.i. prakilogram, valj iz zlitine platine in iridija, ki je bil od leta 1875 do 2019 mednarodni etalon za maso. Prehod na nove definicije osnovnih enot zagotavlja prihodnjo stabilnost SI in odpira priložnost za uporabo novih tehnologij, vključno s kvantnimi tehnologijami, za izvajanje definicij merskih enot in v podporo bolj točnim merjenjem veličin z izvedenimi enotami [11].

Slika 1: Prakilogram (replika) prototipnega kilograma v pariškem muzeju Cité des Sciences et de l’Industrie
Medlaboratorijske primerjave, ki jih izvajajo svetovalni odbori (Consultative Committees – CC) Mednarodnega odbora za uteži in mere (International Committee of Weights and Measures – CIPM) ali Mednarodni urad za uteži in mere (BIPM), se imenujejo ključne primerjave CIPM. Rezultati statistične analize podatkov iz ključne primerjave CIPM so referenčna vrednost ključnih primerjav, stopnja enakovrednosti merilnih rezultatov in z njimi povezane merilne negotovosti.
Stopnja enakovrednosti merilnih rezultatov predstavlja stopnjo skladnosti med vrednostjo merilnega etalona in referenčno vrednostjo ključne primerjave. To se izrazi kvantitativno (številčno) z odstopanjem od referenčne vrednosti ključne primerjave ter z negotovostjo tega odstopanja. Ključne primerjave so medlaboratorijske primerjave, ki služijo kot tehnična podlaga za dogovore o medsebojnem prepoznavanju merilnih zmogljivosti (Mutual Recognition Arrangements – MRA) med nacionalnimi meroslovnimi inštituti (National Metrology Institute – NMI) [12].
Ključne primerjave, ki jih izvajajo regionalne meroslovne organizacije (RMO), se imenujejo ključne primerjave RMO [13]. Rezultati ključnih primerjav se vpišejo v bazo podatkov (Key Comparison Database – KCDB) [14]. BIPM vzdržuje spletno stran KCDB http://kcdb.bipm.org/, da zagotovi javni dostop do podatkov o ključnih primerjavah in kalibracijskih ter merilnih zmogljivostih (CMC) nacionalnih meroslovnih inštitutov.
Vključeni podatki so bili medsebojno pregledani in odobreni za vzajemno priznavanje s postopki, opredeljenimi v CIPM MRA. V praksi nihče ne more imeti boljših merilnih zmogljivosti, kot so objavljene v KCDB, pa vendarle se pojavljajo številni, celo akreditirani laboratoriji, z navedbami brez dokazov, ki bi temeljili na medlaboratorijskih primerjavah, da znajo določeno veličino izmeriti boljše oziroma bolj točno od najboljših meroslovnih laboratorijev.
2. Novi koronavirus SARS-CoV-2
Konec decembra 2019 je podružnica Svetovne Zdravstvene Organizacije (World Health Organization – WHO) iz Kitajske obvestila WHO o izbruhu nove pljučnice neznanega izvora. 7. januarja 2020 je bila objavljena prva sekvenca celotnega genoma domnevnega povzročitelja, ki so ga našli v bronhoalveolarnemu izpirku 41-letnega bolnika, virusa SARS-CoV-2. Brez kakršnihkoli drugih, za to potrebnih dokazov, so sporočili, da je novi koronavirus povzročitelj simptomov. Način dokazovanja povzročitelja je ekvivalenten poročanju novinarja za senzacije: “Na kraju dogodka smo našli gasilce (ali samo nekaj čelad, cevi in sekir)… verjetno so prav gasilci tisti, ki so zanetili požar.”
2.1. Sekvenca genoma SARS-CoV-2
Uradno so prvič sekvencirali genom novega koronavirusa v laboratoriju profesorja Yong-Zhen Zhang-a in ga objavili 7. januarja 2020 v genski banki (GenBank) pod številko MN908947 [15]. Za sekvenciranje so uporabili RNK material, ki so ga našli v bronhoavleolarnem izpirku 41-letnega bolnika. Bolnik je prišel sedmi dan po začetku simptomov v centralno bolnišnico v Wuhanu na Kitajskem z vročino, oteženim dihanjem in suhim kašljem. Z začetnimi etiološkimi raziskavami so izključili prisotnost virusa gripe in adenovirusov, klamidije (C. pneumoniae) in mikoplazme (M. pneumoniae), ki so le štirje od znanih mikroorganizmov, ki lahko napadajo dihalne organe [16].
Moti nas, da so za izdelavo prve knjižnice, s katero se RNK mikrobov in človeškega RNK prepiše nazaj v stabilnejši DNK in ga namnoži za shranjevanje in vso nadaljno obdelavo v laboratoriju v Shanghaju uporabili orodje, ki je namenjeno za delo s sesalci in ne z virusi (SMARTer Stranded Total RNA-Seq Kit v2 – Pico Input Mammalian, Takara, Japonska). 150 nukleotidov vsake molekule DNK v knjižnici je bilo sekvenciranih. Dobili so kar 56,5 milijonov odčitkov (reads). Pri sestavljanju na podlagi prekrivanja zaporedij v daljša, ki jim pravimo sestavljena zaporedja (assembled contigs), so uporabili dva različna računalniška programa (Megahit in Trinity).
Zaporedja, ki sta jih sestavila programa, med sabo niso bila ekvivalentna, saj je Megahit sestavil nekaj čez 348.000 zaporedij z dolžino od 200 do 30.474 nukleotidov, Trinity pa nekaj čez milijon takih zaporedij z dolžino od 201 do 11.760 nukleotidov. Vsem tem dobljenim zaporedjem so nato odstranil domnevna človeška zaporedja tako, da so jih primerjali z znanimi bazami podatkov za človeški genom. Za veliko sekvenc, ki so v bazi podatkov človeskega genoma, ni znanstveno dokazano, da so prepisane v RNK. Na pomoč nam spet pristopijo računalniški modeli, ki izračunajo, katera sekvenca je lahko prepisana v RNK.
Tako so izločili približno polovico neuporabnih človeških zaporedij in določili, da vsa ostala zaporedja pripadajo virusom ali baktarijam. Med preostalimi sta bili tudi najdaljši sekvenci, ki sta ju sestavila Megahit (30.474 nukleotidov) in Trinity (11.760 nukleotidov). Ker sta obe sekvenci zelo podobni celotni sekvenci, ki so jo leta 2018 določili v netopirju (bat SL-CoVZC45; GenBank MG772933), so sklepali, da gre za soroden virus. Za daljšo sekvenco (30.474 nukleotidov) trdijo, da je pokrivala skoraj celoten ‘viralni genom’, ampak končna sekvenca, ki so jo objavili 7. januarja vsebuje le 29.903 nukleotidov. Sprašujemo se, kam je izginil del 571 nukleotidov, ki so razlika med sestavljeno sekvenco v Megahitu in objavljeno sekvenco?
V drugem laboratoriju so sekvencionirali vzorce treh bolnikov, prav tako iz Wuhana. Rezultati so bili konec januarja 2020 objavljeni v članku New England Journal of Medicine (NEJM) [17]. Potek sekvenciranja v tem članku ni podrobno opisan, opisane in objavljene pa so bile tri različne sekvence, za vsakega bolnika posebej. Vse tri sekvence so bile podobne sekvencam MERS-CoV in SARS-CoV. Tako kot pri prvem pacientu se tudi ta študija ni nadaljevala po Kochovih postulatih, s katerimi bi te viruse dejansko dokazali kot povzročitelje pljučnic, in to avtorji jasno napišejo v svojem članku.
Potrebno se je zavedati, da vsa določanja zaporedja nukleotidov, s katerimi naj bi se točno določana vrsta virusa identificirala, slonijo na računalniških modelih. Nikoli ne dobimo celotnega zaporedja virusnega genoma, ampak vedno moramo celotno sliko sestaviti, pri tem pa se poslužujemo verjetnostnega računa. Vse molekule RNK, ki so v vzorcu, se namnožijo v zelo kratke delčke, ki so sekvencirani (150 nukleotidov) in se potem le-te sestavljajo nazaj v prvotne molekule skozi računalniški model. Proces je podoben igranju z Lego kockami. Če hočemo iz Lego kock sestaviti raco, jo bomo sestavili, in to na veliko možnih načinov, samo kocke je potrebno poiskati. Prav tako pa bomo lahko iz njih sestavili ribo.
2.2 Virusi kot povzročitelji bolezni in Kochovi postulati
Latinska beseda “virus” pomeni strup. Učili so nas, da je virus majhen povzročitelj bolezni, ki pa se lahko razmnožuje le v celicah, saj sam nima celičnih mehanizmov, ki so potrebni za razmnoževaje. Za to potrebuje živo celico, gostitelja in pri tem uporabi njegovo infrastrukturo za razmnoževanje. Če bi hoteli dokazati možnost okužbe z virusom, bi izolirani virus tako morali najprej namnožiti na celičnih kulturah, ga namnoženega ponovno izolirati in z njim okužiti izbrani živalski model za bolezen. Če bi žival zbolela za podobno boleznijo, potem bi izbranemu, ponovno izoliranemu virusu lahko pripisali bolezen (to je sinteza Kochovih postulatov). Ker je tak postopek skoraj nemogoče izvesti z virusom, se jim kar pripiše, da povzročajo nalezljive bolezni.
Veliko tega, kar vemo o človeskih virusih, se je preneslo iz študija bakteriofagov (virusov bakterij). Za bakteriofage sta leta 1952 znanstvenika Hershey in Chase dokazala, da je dedni material le-teh nukleinska kislina in od takrat se je brez dokazov to “vedenje” preneslo tudi v viruse višjih organizmov, čeprav strukture, ki so pod elektronskim mikroskopom označene kot virusi, niso bile še nikoli biokemično opredeljene. Od takrat naprej se je začelo določevati prisotnost virusa s prisotnostjo nukleinske kisline in v 80-ih letih z uporabo PCR tehnologije. Preproste in logične Kochove postulate so proglasili za zastarele in jih zamenjali za novo “občutljivejšo tehnologijo”. Ta pa temelji le na računanju verjetnosti, kjer ni ničesar gotovega [slika 2 prirejena iz 18].

Slika 2: Primerjava standardne in nove tehnologije
Pred časom se je pokazal problem tudi pri nedokazljivosti virusov kot povzročiteljev rakavih obolenj. V članku (review) Moore and Chang [19] sta tako avtorja napisala, da so Kochovi postulati sicer odličen primer natančnega znanstvenega mišljenja, vendar pa ne premorejo praktične vrednosti, ki je potrebna v tumorski virologiji 21. stoletja. S tem sta poskusila opravičiti, zakaj virusov nista mogla dokazati za povzročitelje raka. Sprašujemo se, zakaj namesto tega, da sta ovrgla Kochove postulate, raje nista odrešila virusov kot povročiteljev simptomov oz bolezni, saj enako velja tudi za ‘viruse’, ki naj bi povzročali druge simptome (kot je recimo gripa ali pa COVID-19). Več o tem je v tem zborniku že napisal Gregor Knafelc, dr. dent. med.
2.3 Kako določiti virusno obremenitev?
Brisi so za določanje virusne obremenitve zelo problematičen način jemanja vzorca, saj je pri njem težko določiti začetno količino odvzetega biološkega materiala. Tudi če bi bila PCR tehnologija ustrezna za diagnosticiranje virusa, bi še vedno obstajal problem, kako določiti število virusov oziroma koncentracijo, ki je potrebna, da človek razvije simptome bolezni COVID-19. Če bi hoteli biti natančni, potem bi potrebovali notranji standard RNK, ki bi imel točno določeno koncentracijo v brisu vsakega človeka in bi ga potem po istem postopku pretvorili nazaj v DNK, namnožili s PCR.
Na podlagi določene Ct takšnega notranjega standarda bi tudi lahko sklepali na količino začetnega materiala odvzema brisa. Ker tega nimamo, nikoli ne vemo, kako prilagajati število ciklov glede na količino začetnega materiala. Tako se nam lahko zgodi, da je materiala malo in ravno zaradi tega ne dobimo pozitivnega rezultata in obratno. Če bi pri vsem tem hoteli biti bolj natančni (in je virus res prisoten v človeku), bi prisotnost virusa merili v krvi ali v slini, ker bi tako dobili kot rezultat vsaj koncentracijo, česar pri brisu ni. Tak odvzem materiala za testiranje bi bil tudi bolj obvladljiv in manj travmatičen (nosni bris lahko resno poškoduje nosno sluznico).
3. PCR tehnologija
3. 1 Uvod
Verižna reakcija s polimerazo (Polymerase Chain Reaction – PCR) je metoda, ki se uporablja v molekularni biologiji. Leta 1983 jo je razvil ameriški biokemik Kary Mullis, za katero je leta 1993 dobil Nobelovo nagrado za kemijo. S PCR metodo se kopira in pomnožuje odseke DNK verige.
Kopiranje odsekov DNK poteka tako, da uporabimo dve kratki molekuli DNK (primer na sliki 3), ki sta komplementarni (ujemata se kot ključ in ključavnica) začetnemu in končnemu delu segmenta, ki ga želimo pomnnožiti. Dodamo še gradnike (deoksiribonukleotide), delavce, ki bodo zlagali ustrezne gradnike (polimeraze) in raztopino soli. Reakcija poteka verižno, to pomeni, da jo večkrat ponovimo. Vsaka nova molekula DNK je kot vrstica gradnikov, ki jih zlaga delavec, le da vsak gradnik v naslednji poziciji potrebuje komplementarni gradnik. Vsaka ponovitev se imenuje cikel, v katerem se zelo natančno spreminja temperatura (denaturacija, prileganje začetnih oligonukleotidov, prepisovanje). V vsakem takem ciklu se podvoji količina segmenta DNK. Tako se od ene molekule po 20 ciklih naredi približno milijon molekul (106) z enako sekvenco, po 30 ciklih pa še 1000-krat več (ca. 1 miljardo; 109).
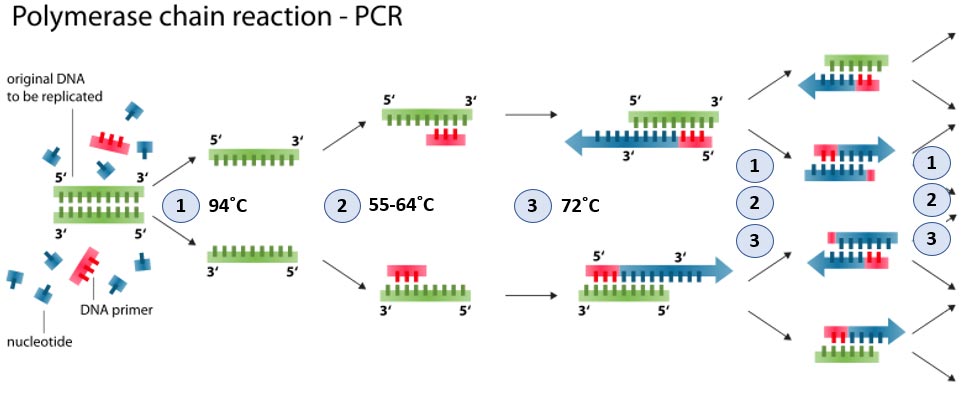
Slika 3: Shema poteka PCR
Za točno štetje novo sintetiziranih molekul se uporablja kvantitativna ali real-time RT-PCR, ki ob vsakem PCR ciklu sprosti določeno količino fluorescence (sorazmerno s številom sintetiziranih novih molekul). Ko je ta fluorescenca nad pragom, ki bi bil lahko le šum v ozadju (threshold), program to registrira kot Ct. Če je številka zelo visoka pomeni, da je bilo potrebno narediti veliko ciklov za sprostitev fluorescence, ki jo je instrument lahko zaznal, in to pomeni, da je bilo začetnega materiala zelo malo. Večkrat pa se pri PCR pomnoževanju zgodi, da po določenem številu ciklov dobimo signal tudi v čisti vodi (aspecifično pomnoževanje).
Število Ct seveda ne pove nič o kvaliteti pomnoženega materiala (recimo najbolj pogosta napaka je, da sekvenca ni enaka začetni, kar bi pomenilo, da delavec nekje med zidavo vgradi napačen gradnik in od tam naprej so vsi gradniki v tisti poziciji napačni) in pa tudi ne o kvaliteti začetnega materiala. Pri diagnostiki se vedno s PCR pomnožuje dve sekvneci, za kateri je najbolje, da sta vsaka na svojem koncu genoma (ena za zacetku, ena na koncu). Če pri obeh dobimo določeno število Ct (ki pa ni bilo nikoli identificirano) proizvajalec pravi, da je test pozitiven za prisotnost virusa. Potrebno je paziti, ker ni nujno, da sta ti dve sekvenci res del dolgega genoma virusa, ki bi lahko nekoga okužil ali pa sta ti dve sekvenci ostanek razgrajenega virusnega genoma, ki seveda ni več nevaren.
3.2 Umerjanje PCR tehnologije za diagnozo virusa
Pri uporabi PCR za diagnozo virusa pa imamo še dodatni problem, in sicer če bi že hoteli PCR tehnologijo uporabiti za diagnozo virusa, bi bilo potrebno najprej narediti pravo umerjanje. Tega ne more v celoti nadomestiti umetno sintetiziran delček RNK, ki ga dodamo raztopini vzorca. Tak zunanji standard sicer nekaj pove o kvaliteti prepisa, vendar ne more sklepati na količino in kvaliteto začetega materiala, kar smo omenili že pri virusni obremenitvi.
Prav tako bi moral biti pravi standard umerjen proti pravemu virusnemu standardu, ki bi vseboval genom čistega virusa, izoliranega in preverjenega s Kochovimi postulati. Tako pa imamo namesto pravega virusnega standarda le računalniški model, ki ima izračunano le določeno stopnjo verjetnosti, da pripada določenemu virusu.
Očiščeni virus bi tako morali razdeliti na alikvote z različnimi koncentracijami in iz vsake vzeti določen volumen, s katerim bi okužili živalski model, s preostankom vsakega alikvota pa bi morali narediti real-time RT-PCR. Pri tem bi dobili direktno korelacijo, kakšna je minimalna količina virusa, ki še lahko okuži žival in ga primerjati s Ct pri dani koncentraciji alikvota virusa. Seveda že obstajajo kritike k takšnemu pristopu, saj nekateri sklepajo, da so koncentracije virusa, ki lahko okužijo človeka, da zboli, različne, saj se imunski sistemi ljudi med seboj razlikujejo. Po logiki torej, če nadaljujemo s takim pristopom, potem lahko zaključimo tudi, da število ciklov pri ločevanju ljudi na simptomatske in asimptomatske ne pomeni ničesar, ker vsak človek po svoje reagira na virus, če le-ta obstaja.
Ker do danes še nikomur ni uspelo izolirati virusa SARS-CoV-2, kar je problem tudi pri ostalih virusih, je govoriti o PCR testu kot relevantnem testu za diagnozo ‘virusa’ brezpredmetno. PCR s pomočjo specifičnih prajmerjev (v angleščini “primers”) le pomnoži neko sekvenco, za katero je računalniški model izračunal, da verjetno pripada genomu tega novega ‘virusa’, ki so mu nadeli ime SARS-CoV-2.
Joint Committee for Traceability in Laboratory Medicine (JCTLM) je lani objavil posebno izdajo JCTLM glasila o COVID-19 [20]. V njem je veliko napisano o RNK materialu, ki naj bi podprl diagnostične PCR teste. Pomanjkljivost je v tem, da je omenjeni material umetno sintetizirana RNK sekvenca, ki nam lahko pomaga le pri umerjanju PCR testa samega (da potrdimo, če inštrument pravilno deluje in če se ni zgodila kakšna človeška napaka), drugih informacij pri tem ne dobimo.
3.3. Specifičnost PCR testa za diagnozo virusa
V Sloveniji NLHOZ uporablja metodo PCR v realnem času po reverzni transkripciji Allplex 2019-nCoV (Seegene Inc., Južna Koreja) kot referenčno RT PCR metodo [21]. S selektivnostjo testa preverjamo, kaj metoda meri. Ne gre za vprašanje količine, ampak za kvaliteto. Istovetnost virusnih odsekov, ki jih uporabljajo pri tej metodi, je sicer vprašljiva, saj virus ni bil izoliran, kar smo že omenili. Unikatnost, kar pomeni, da se ti odseki ne pojavijo v nobeni od molekul RNK v celem virusnem, bakterijskem, rastlinskem, glivnem in živalskem kraljestvu, je tudi vprašljiva.
Za Allplex 2019-nCoV metodo so ugotovili, da ima omejitve [22]. Napišejo v končnem povzetku (omejitve testa), da ta metoda lahko navzkrižno reagira tudi na druge koronaviruse (podrod Sarbecovirus), ki povzročajo prehlade, ampak ker jih sedaj ni v cirkulaciji (dokaza ni na voljo) se to možnost ovrže, tako da so pozitivni lahko le SARS-CoV-2 [22]. Za test torej trdijo, da je specifičen in meri le RNK SARS-CoV-2 in ničesar drugega. V drugem delu “navodil za uporabo” Allpex metode (85 strani, ki bi si jih moral vsak uporabnik prebrati, še posebej, če je test uporabljen za diagnostiko, a si jih ne) piše, da je bila za Allplex 2019-nCoV Assay izvedena računalniška analiza (“in silico”).
S to analizo se oceni možnosti navzkrižne reaktivnosti PCR prajmerjev (v angleščini “primers”) s sekvencami patogenov, ki jih lahko srečamo v kliničnih vzorcih dihal [22]. Za to analizo se v računalnik vstavi arbitraren parameter, ki je bil v tem primeru 80% podobnosti med prajmerjem in ciljno sekvenco. Če je stopnja ujemanja pod 80%, to pomeni da navzkrižne reakcije ni. Ugotovili so, da so prajmerji, ki so jih tako “testirali” secifični za sekvenco SARS-CoV-2. Poleg tega so okrog 60 različnih vrst patogenov tudi zares testirali.
Dognali so, da ta test reagira le na SARS-CoV-2, čeprav podrobnosti, kako so test izvedli, ni napisanih (na primer koliko ciklov je PCR naredil). V tabeli so sicer navedeni viri organizmov, ki so jih testirali, za katere pa je znano, da to niso očiščeni virusi. Sprašujemo se tudi, od kje imajo sekvenco genoma, saj le ta ni bila fizično nikoli izolirana kot ena molekula iz virusa SARS-CoV-2. Enako lahko rečemo tudi za virus influenze in za ostale viruse.
Ker so klinični znaki respiratornega obolenja dobro rešeto, ki nam prihrani mnogo testiranja za specifičnost, smo delno pri bolnikih s simptomi s specifičnostjo zadovoljni. Vendar pa tega nikakor ne moremo trditi za zdrave ljudi. Pri zdravih ljudeh bi morali za potrditev specifičnosti testirati še vse preostale viruse in vse žive organizme, da bi nadomestili tisti del, ki ga lahko nadomestimo s kliničnimi znaki. Kako smo lahko prepričani, da PCR ni pomnožil neke sekvence, ki je zašla v naš nos po pomoti, in ni ‘SARS-CoV-2 genom’ in tudi ne delček tega genoma?
Nos je prvi filter zraka, ki ga človek vdihne. Veliko od teh snovi sploh ne pride v organizem, kjer bi se toliko namnožile, da bi spet lahko prišle v izdihani zrak in okužile druge ljudi. Ugotavljanje specifičnosti Allplex 2019-nCoV Assay testa za zdrave ljudi so sicer hoteli nadomestiti z združenimi nosnimi izpirki več ljudi [22]. Nikjer pa ne piše, koliko ljudi je sodelovalo v raziskavi, od kod so bili, kakšna atmosfera je bila okoli njih, predvsem pa je bila koncentracija zelo nizka, saj je bil izpirek razredčen.
Če bi zares hoteli dokazati specifičnost, bi morali biti ti podatki jasni in navedeni. Poleg tega bi morala vsaka država še dodatno narediti teste specifičnosti vsaj glede na različna okolja in glede ne različne populacije (mesta, tovarne, bolnišnice, domovi za ostarele, starostne skupine…). Nenazadnje pa je res tudi to, da je nazofarinks v tem primeru najslabša izbira. Serumski vzorec bi bil boljši glede na zgornje ugotovitve, definitivno pa specifičnost ni potrjena za vzorec brisa nazofarinksa.
Zelo zanimivo je, da se je proizvajalec testa Allpex vprašal, zakaj je lahko test negativen (to pomeni, da je lažno negativen), in si dal tudi odgovore: 1. koncentracija vzorca je blizu ali pa pod mejo zaznavnosti testa, 2. prisotna je mutacija v ciljni sekvenci prajmerja, 3. drugi faktorji.
Če je možno, da so testi lažno negativni, ali je potem tudi možno, da so testi lažno pozitivni? Že od lani se nekateri to sprašujemo, ampak odgovor od “stroke” je, da to pa ni možno. Ali jim lahko verjamemo? Seveda ne, ker 100 % gotovost ne obstaja.
Glede specifičnosti imamo tudi zelo konkretna vprašanja, kako ima Slovenija urejeno PCR testiranje. Koliko različnih testov od različnih proizvajalcev se uporablja in koliko aparatur? Ali so ti testi primerjani med seboj v smislu da različni proizvajalci, nastavitve, vključno s cikli, dajo enak rezultat? Slednje seveda ni možno, vendar bi nas vseeno zanimal raztros vrednosti dobljenih z različnimi testi pri istem vzorcu in pogojih testiranja. Ali uporabljajo vsi enako število prajmerjev (“primers”) ? Povsem pa nas zanima, kakšna je povezava med pozitivnim testom pri zdravih ljudeh in nadaljevanjem bolezni? Ali je človek potem zares zbolel, kako resna je bila bolezen in ali je na koncu umrl?
3.4 Kritika PCR testov s strani neodvisnih znanstvenikov
Ko so začeli uporabljeti PCR tehnologijo za diagnozo virusa HIV, je imel izumitelj zadržke, ker ta tehnologija lahko le pomnoži kratke delčke nukleinskih kislin, ne more pa o le-teh povedati ničesar. Že sam izumitelj je poudarjal, da ta tehnologija ne bi smela biti uporabljana za diagnozo virusov in virusnih obolenj.
Malo po tem, ko je bila objavljena prva sekvenca, za katero je bilo sicer arbitrarno določeno, ne pa tudi dejansko dokazano, da pripada virusu SARS-CoV-2, sta Corman in Drosten s soavtorji objavila članek [23], ki natančno opisuje RT-PCR metodo, ki naj bi bila primerna za določanje novega virusa. V tem delu avtorji že na začetku poudarijo, da v rokah niso imeli standarda resničnega virusa, ampak le neko računalniško sekvenco, ki je bila objavljena 7. januarja. Članek je bil objavljen bliskovito, le 48 ur po sprejemu v publikaciji Eurosurveillance.
Z naše strani je najbolj resna kritika glede uporabe PCR tehnologije za diagnozo SARS-CoV-2 verodostojnost standarda. Test ni bil nikoli pravilno umerjen, kot je napisano v točki 3.2, da bi lahko povezal Ct vrednost z možnostjo obolenja (razvojem simptomov). Koncem novembra lani pa je skupina uglednih neodvisnih znanstvenikov pregledala članek in poslala poročilo [24] s svojimi kritikami in pomisleki na Eurosurveillance. Pri tem so zahtevali da se Corman-Drosten članek umakne iz objave.
Povzetek napak, ki jih navajajo:
- V protokolu ni nobenega natančnega razloga za uporabo izjemno visokih koncentracij prajmerjev. Previsoke koncentracije povzročijo nespecifično vezavo in previsoke tvorbe nespecifičnih produktov PCR, zaradi česar je test neprimeren kot posebno diagnostično orodje za prepoznavanje virusa SARS-CoV-2.
- Več prajmerjev nima točno določene sekvence (na eni poziciji sta lahko dva različna nukleotida) in to bo prineslo ogromno variabilnost v laboratorijskih izvedbah tega testa v resničnem svetu; zmeden nespecifičen opis v prispevku Corman-Drosten ni primeren kot standardni operativni protokol, zaradi česar je test neprimeren kot posebno diagnostično orodje za prepoznavanje virusa SARS-CoV-2.
- Test ne razlikuje med celotnim virusom in le prisotnostjo posameznih virusnih fragmentov. Pri diagnostiki je potrebno določiti le celotne, okužbe zmožne viruse.
- Optimalne temperature polimeraz, ki so vključene za prepis 12 različnih segmentov virusa, se med saboj zelo razlikujejo, tudi do 10 °C glede na temperaturo žarjenja Tm (RdRp_SARSr_F in RdRp_SARSr_R). Zato je ta test neprimeren kot diagnostično orodje.
- Huda napaka je tudi navedba vrednosti Ct, ki ločuje vzorce na negativne in pozitivne.
- PCR rezultati niso bili potrjeni na molekularni ravni.
- Test PCR ne vsebuje niti edinstvene pozitivne kontrole za oceno njegove specifičnosti za SARS-CoV-2 niti negativne kontrole za izključitev prisotnosti drugih koronavirusov.
- Preskusna zasnova v objavi Corman-Drosten je tako nejasna in pomanjkljiva, da gre v ducate različnih smeri; material ni standardiziran, niti ni standardiziranega postopka testa.
- Najverjetneje objava Corman-Drosten ni bila strokovno pregledana.
- Ugotavljamo hudo navzkrižje interesov za vsaj štiri avtorje, poleg tega pa sta dva avtorja prispevka Corman-Drosten (Christian Drosten in Chantal Reusken) člana uredništva Eurosurveillance-a, ki je publikacijo izdalo. 29. julija 2020 je bilo dodano navzkrižje interesov (Olfert Landt je izvršni direktor TIB-Molbiol; Marco Kaiser je višji raziskovalec pri GenExpress in znanstveni svetovalec v TIB-Molbiol), kar v prvotni različici ni bilo prijavljeno (in še vedno ni v različici PubMed); TIB-Molbiol je podjetje, ki je “prvo” izdelalo komplete PCR (Light Mix) na podlagi protokola, objavljenega v rokopisu Corman-Drosten, in po njunih lastnih besedah so komplete za PCR testiranje delili celo preden je bila podana vloga za objavo. Poleg tega Victor Corman in Christian Drosten nista omenila svoje druge pripadnosti, komercialnega testnega laboratorija “Labor Berlin”. Oba sta tam odgovorna za diagnostiko virusov, družba pa se ukvarja s PCR testiranjem. (KAKŠNO PRESENEČENJE).
Po dveh mesecih so iz Eurosurvelliance odgovorili, da njihovi notranji sodelavci niso našli v originalnem članku ničesar spornega in s tem poskusili zavrniti vse kritike. So nas uspeli prepričati?
Literatura
[1] ISO 5725-1, Accuracy (trueness and precision) of measurement methods and results — Part 1: General principles and definitions
[2] http://www.lmk.si/wp-content/uploads/2015/06/Merilna-negotovost-za-zacetnike-5.pdf
[3] https://www.bipm.org/documents/20126/2071204/JCGM_100_2008_E.pdf/
[4] ISO/IEC 17025:2017 General requirements for the competence of testing and calibration laboratories
[5] ISO/IEC 17043:2010 Conformity assessment — General requirements for proficiency testing
[6] ISO 15189:2012 Medical laboratories — Requirements for quality and competence
[7] ISO 3951-1:2013 Sampling procedures for inspection by variables — Part 1: Specification for single sampling plans indexed by acceptance quality limit (AQL) for lot-by-lot inspection for a single quality characteristic and a single AQL
[8] ISO 3951-2:2013 Sampling procedures for inspection by variables — Part 2: General specification for single sampling plans indexed by acceptance quality limit (AQL) for lot-by-lot inspection of independent quality characteristics
[9] https://ec.europa.eu/jrc/en/interlaboratory-comparisons
[10] https://www.bipm.org/en/metre-convention
[11] https://www.bipm.org/en/measurement-units
[12] Kacker RN et al. (2003)Statistical Interpretation of Key Comparison Reference Value and Degrees of Equivalence. J Res Natl Stand Technol; 108: 439-446. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4844517/
[13] Mutual recognition of national measurement standards and of calibration and measurement certificates issued by national metrology institutes. International Committee of Weights and Measures (CIPM); Oct 14, 1999.
[14] https://www.bipm.org/kcdb/
[15] https://www.ncbi.nlm.nih.gov/nuccore/MN908947
[16] Wu F et al. (2020) A new coronavirus associated with human respiratory disease in China. Nature; 579: 265-269.
[17] Zhu N et al. (2020) A Novel Coronavirus from Patients with Pneumonia in China, 2019. NEJM; 382: 727-733.
[18] Flint J et al. Principles of Virology 4th edition; Volume II Pathogens and Control. ASM Press 2015.
[19] Moore PS and Chang Y (2014) The conundrum of causality in tumor virology: the case of KSHV and MCV. Semin Cancer Biol; 26:4-12.
[20] https://www.bipm.org/documents/20126/42834057/JCTLM-Newsletter-2020-COVID-19.pdf/
[21] https://www.nlzoh.si/wp-content/uploads/2021/04/Porocilo-o-verifikaciji-HAT-za-samotestiranje.pdf
[22] https://www.fda.gov/media/137178/download
[23] Corman VM et al (2020) Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 25:2000045.
[24] Corman-Drosten review report. https://cormandrostenreview.com/report/






